Česká a slovenská psychiatrie

Časopis
Psychiatrické společnosti ČLS JEP
a Psychiatrickej spoločnosti SLS
souborný článek / review article
AKTIVITA CYP2D6 U PACIENTŮ LÉČENÝCH RISPERIDONEM
CYP2D6 TESTING IN PATIENTS TREATED WITH RISPERIDONE
Richard Barteček1, Jan Juřica2, Jana Zrůstová3 , Eva Pindurová1, Tomáš Kašpárek1, Alexandra Žourková1
1 Psychiatrická klinika LF MU a FN Brno
2 Farmakologický ústav LF MU Brno
3 Oddělení lékařské genetiky FN Brno
2 Farmakologický ústav LF MU Brno
3 Oddělení lékařské genetiky FN Brno
Práce byla podpořena grantem NS 9676-4/2008
SOUHRN
Barteček R, Juřica J, Zrůstová J, Pindurová E, Kašpárek T, Žourková A. Aktivita CYP2D6 u pacientů léčených risperidonem
V reaktivitě pacientů na psychofarmaka existuje značná interindividuální variabilita. Farmakogenetika zkoumá možnost predikce odpovědi pacienta na léčbu. Jedním z kandidátů pro farmakogenetické testování je enzym CYP2D6, který metab olizuj e několik psychofarmak včetně antipsychotika risperidonu. Risperidon a jeho metabolit 9-OH-risperidon vykazují nezanedbatelné rozdíly, z nichž nejdůležitější je snížená prostupnost 9-OH-risperidonu přes hematoencefalickou bariéru.
Aktivitu CYP2D6 lze odhadnout genotypizací a určit fenotypizací např. dextromethorfanovým testem. Fenotypizace dokáže určit aktuální aktivitu enzymu, tedy sumu genetických vlivů i vlivů prostředí, včetně možného inhibičního vlivu některých léčiv nebo xenobiotik.
CYP2D6 se může vyskytovat ve čtyřech fenotypických variantách, nejčastější je rychlý metabolizátor. Intermediární metabolizátor a pomalý metabolizátor mají sníženou, resp. nulovou aktivitu CYP2D6 a dle celé řady studií u nich lze očekávat vyšší výskyt a tíži nežádoucích účinků léčby. Čtvrtou variantou je ultra-rychlý metabolizátor, u něhož lze očekávat nižší účinnost risperidonu. Vedle studií, které prokázaly výše zmíněný vliv rozdílných fenotypu CYP2D6 při léčbě risperidonem, existují studie, který takový vliv neprokázaly. Přesný dopad rozdílných fenotypu CYP2D6 proto zůstává nejasný a bude třeba dalších, zejména prospektivních studií, aby bylo možno určit, jestli má farmakogenetické testování CYP2D6 při léčbě risperidonem své místo v klinické praxi.
Klíčová slova: farmakogenetika, cytochrom P450, CYP2D6, risperidon, 9-OH-risperidon
SUMMARY
Barteček R, Juřica J, Zrůstová J, Pindurová E, Kašpárek T, Žourková A. CYP2D6 testing in patients treated with risperidone
There is significant interindividual variability in patient reactivity to psycho-pharmacological treatment. Possibility to predict patients response to pharmacological treatment is the focus of pharmacogenetics. One of the promising candidates for pharmacogenetic testing is CYP2D6, enzyme metabolising several psychoactive drugs including antipsychotic risperidone. Risperidone and its metabolite 9-OH-risperidone show considerable differences, one of which is poorer blood-brain barrier permeability of 9-OH-risperidone.
CYP2D6 activity can be estimated by genotypization and phenotypization. Phenotypization is able to determine actual level of enzyme activity even if the CYP2D6 activity has been reduced by CYP2D6 inhibitors.
Four CYP2D6 phenotypic variants exist. The most frequent is extensive metaboliser. Intermediate metaboliser and poor metaboliser have reduced CY-P2D6 activity and according to number of studies there is higher possibility and severity of risperidone adverse effects. The last variety of CYP2D6 phenotype is ultra-rapid metaboliser with possible lower risperidone efficacy. Besides the high number of studies demonstrating effect of CYP2D6 variability, there are studies which did not show its significant impact. Exact amount of CYP2D6 variability effect is therefore still unclear and further studies has to be conducted to find out whether CYP2D6 pharmacological testing has its place in clinical setting.
Key words: pharmacogenetics, cytochrome P450, CYP2D6, risperidone, 9-hydroxy-risperidone
ÚVOD
Základní terapeutickou modalitou u psychotických poruch je farmakoterapie. Z klinické zkušenosti je patrné, že mezi pacienty existuje výrazná interindividuální variabilita v reaktivitě na užitá léčiva. Někteří pacienti dosáhnou při užívání zvolené medikace remise, u jiných se dosáhne jen částečného zlepšení a existují i takoví, u nichž nelze sledovat účinek léku vůbec. U některých pacientů se navíc projevují nezanedbatelné nežádoucí účinky.
Možnost predikovat reaktivitu pacienta na různá léčiva na základě objektivních, dobře měřitelných veličin se tudíž jeví jako žádoucí postup, který by mohl vést k individualizaci léčby. Jednou z možností, jak nahlédnout na heterogenitu odpovědi na léčbu psychofarmaky jsou genetické přístupy. V r. 1959 použil Vogel poprvé termín farmakogenetika,1 mnohem později se objevil termín farmakogenomika.2 Základní hypotézou těchto oborů je, že interindividuální variabilita v odpovědi na léčiva je podmíněna genetickými faktory. Farmakogenetika zkoumá vliv jednotlivých mutací konkrétního genu na efekt léčiva, farmakogenomika pak tuto souvislost zkoumá z pohledu celého genomu. Sledován pak může být přímo genotyp, nebo mohou být sledovány produkty exprese jednotlivých genů - fenotyp.
Výzkum variability na úrovni fenotypu se objevil již v 50. letech minulého století, kdy technologie umožnila identifikaci rozdílů v enzymech metabolizujících léčiva a detekci rozdílných metabolitů užívaných látek.1 Byl to tedy vliv farmakokinetických faktorů na terapeutickou odpověď, který byl zkoumán jako první. Nejdůležitější rodinou enzymů metabolizujících léčiva je cytochrom-P450-oxidoreduktáza s celou plejádou isoenzymů. Enzymy mohou být zkoumány jednak z hlediska fenotypu - stanovováním aktivity enzymu podáním testovací látky a následným stanovením metabolického poměru této látky a jejího metabolitů,3 jednak z hlediska genotypu porovnáním se zdravou kontrolou.
Teprve mnohem později začal výzkum variability farmakodynamických faktorů a jejího vlivu na odpověď na léčbu. Tento výzkum se zprvu soustředil na terapeutické cílové struktury - receptorové systémy, které jsou cílem působení antipsychotik.1 Většina moderních antipsychotik vykazuje afinitu k široké paletě receptoru různých neurotransmiterů včetně dopaminu, serotoninu, histamínu, acetylcholinu, glutamátu, noradrenalinu. Pokud zvážíme rozsah genetické variability v kombinaci s velkým množstvím vzájemně se ovlivňujících potenciálních cílů léčiva, rozsah variability na farmakodynamické úrovni pravděpodobně značně převyšuje variabilitu na úrovni farmakokinetické.
Faktem zůstává, že variabilita metabolismu léčiv je mnohem lépe prozkoumaná. Kupř. u CYP2D6 bylo identifikováno více než 70 SNP (jednonukleotidových polymorfismů - single-nucleotid polymorphism) s dobře definovaným dopadem na aktivitu enzymu, zatímco u "nejnadějnějšího" cíle léčiva - D2 dopaminového receptoru bylo nalezeno pouze několik SNP bez jasně definovaného funkčního dopadu.2 Možnost individualizace léčby s přihlédnutím k farmakokinetickým faktorům je tak mnohem blíž praktickému využití než individualizace na základě faktorů farmakodynamických.
Tento článek se zabývá modelovým příkladem možného vztahu mezi genem, produktem genu a terapeutickou odpovědí na léčivo. Zmíněným modelovým příkladem je vztah mezi variabilitou genu pro CYP2D6, aktivitou enzymu CYP2D6 a efektem risperidonu, který je CYP2D6 preferenčně metabolizován. Protože CYP2D6 metabolizuje velké množství látek užívaných v psychiatrii, stala se psychiatrie jednou z prvních oblastí medicíny vhodnou pro klinické farmakogenetické testování.2 V následujícím textu budou na modelovém příkladě popsána teoretická východiska farmakogenetického výzkumu, použité metody, studie zkoumající klinický dopad interindividuální variability a rovněž možné přenesení takto získaných poznatků do praxe.
CYP2D6
CYP jako I. fáze metabolismu xenobiotik
Cytochrom P450 (CYP) představuje hlavní metabolickou cestu mnoha léčiv a významný zdroj interindividuální variability odpovědi pacientů na léčbu. Systém CYP obsahuje nejvýznamnější enzymy I. fáze metabolismu xenobiotik. Ve vysokém množství jsou obsaženy mimo jiné v membránách endoplasmatického retikula jater, ale také v buňkách střevní stěny, v menší míře pak v buňkách ledvin, plic a mozku. V lidském genomu je 57 genů pro různé isoformy CYP. Každý gen je pojmenován zkratkou CYP, číslem, které udává rodinu, do níž patří (40% shoda v sekvenci aminokyselin), písmenem, které určuje podrodinu (55% shoda v sekvenci aminokyselin), a konečně číslem, které určuje konkrétní enzym. V posledních letech byla identifikována celá řada konkrétních isoforem, z nichž každá vykazuje specifitu pro určité substráty. Z těchto enzymů jsou nejdůležitější CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP2E1 a CYP3A4, které metabolizují 90 % všech léčiv metabolizovaných systémem CYP. Mnoho z léků metab olizovaných CYP patří mezi antidepresiva a antipsychotika.4
S ohledem na metabolismus antipsychotik je nejvýznamnější isoforma CYP2D6 (metabolizuje risperidon, chlorpromazin, haloperidol, aripiprazol), CYP3A4 (metabolizuje quetiapin, v malé míře také klozapin, risperidon, ziprasidon), CYP1A2 (metabolizuje chlorpromazin, klozapin a olanzapin) a CYP2C19 (metabolizuje v malé míře klozapin).1
CYP2D6 a jeho variabilita - fenotypická, genotypická, jejich vzájemný vztah
CYP2D6 je isoenzym, jenž biotransformuje až 30 % léčiv metab olizovaných CYPy CYP2D6 vykazuje největší interindividuální variabilitu ze všech cytochromů. Za to mohou faktory genetické, k široké variabilitě však přispívá možnost ovlivnění aktivity CYP2D6 jinými látkami - inhibitory jeho aktivity.
Gen pro CYP2D6 se nachází na dlouhém raménku 22. chromosomu.2 Jednotlivé alely tohoto genu mohou podmiňovat expresi plně funkčního enzymu, částečně funkčního enzymu, nebo zcela nefunkčního enzymu. Nejčastější alelou v naší populaci je CYP2D6*1 - podmiňuje expresi plně funkční formy, nejčastějšími dysfunkčními alelami jsou CYP2D6*3, *4 a *5.4
Čtyři hlavní fenotypické varianty jsou: ultra-rychlý metabolizátor (ultra-rapid metaboliser, UM), jenž vykazuje vyšší než trojnásobnou aktivitu oproti nejčastější variantě, kterou je rychlý metabolizátor (extensive metaboliser, EM). Pomalý metabolizátor (poor metaboliser, PM) vykazuje nulovou aktivitu CYP2D6. Aktivita inter-mediárního metabolizátora (intermediate metaboliser, IM) je v oblasti mezi EM a PM.5
EM má dvě plně funkční alely genu pro CYP2D6, IM má jednu alelu podmiňující enzym s nulovou aktivitou a jednu alelu s částečnou aktivitou. PM má obě alely podmiňující zcela nefunkční enzym; výše zmiňované alely CYP2D6*3, *4 a *5 odpovídají za 98 % všech PM v populaci.4 UM pak má více kopií plně funkční alely, se zvýšenou aktivitou se pojí pouze přítomnost multiplikací alel podmiňující expresi aktivního enzymu - 2D6*1XN, *2XN a *35XN; existují však i jedinci, kteří jsou fenotypicky UM, ale bez duplikace nebo multiplikace plně funkční alely. Přesný mechanismus zvýšení aktivity CYP2D6 u těchto jedinců není znám.2
Různý výskyt v populaci
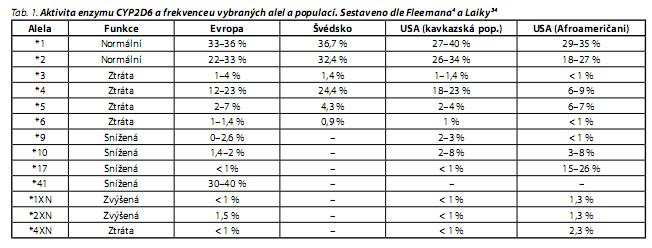
Zastoupení jednotlivých fenotypu se v různých populacích liší. Dle de Leona je v americké populaci fenotyp UM zastoupen v 1,5 %, přičemž v populaci bílých Američanů je to 1,4 % a v populaci Afroameričanů 2,7 %; IM jsou mnohem častější ve východoasijské populaci než v evropské.5 U Evropanů se vyskytuje 7 % PM, zatímco u Asiatů a Afričanů asi 1-3 %.5 Udávaná procenta se však dle různých zdrojů mohou lišit. Pro srovnání - zastoupení některých alel pro gen CYP2D6 v různých populacích v tab. 1.
Inhibitory a induktory
CYP2D6 metabolizuje velké množství substrátů, a tak je zde velký potenciál pro nejrůznější lékové interakce. Pacienti se schizofrenií mohou užívat léky v nejrůznějších kombinacích, avšak u těchto jedinců je vyšší riziko nežádoucích důsledků polypragmazie.
Aktivita CYP2D6 může být snížena inhibitory. Inhibice CYP může být reverzibilní nebo ireverzibilní. V případě reverzibilní inhibice je funkce daného CYP okamžitě po vyloučení inhibitoru obnovena, ale v případě ireverzibilní inhibice musí být syntetizován nový enzym, aby se obnovila aktivita CYP. Reverzibilní inhibice je závislá na dávce, vlastnostech molekuly a vylučovacím poločase daného inhibitoru, přičemž při metabolizaci inhibitoru mohou vzniknout látky s odlišným typem inhibice i poločasem vylučování. Ireverzibilní inhibice je navíc závislá na čase nutném pro syntézu nového enzymu.
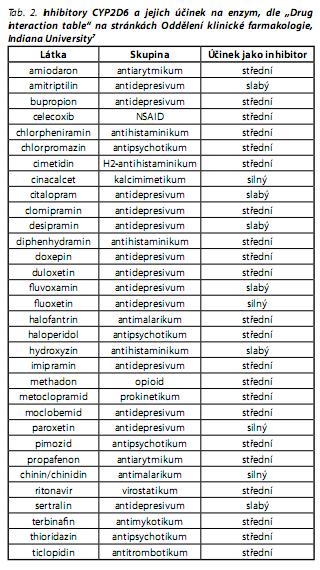
Mezi inhibitory CYP2D6 patří látky, které se při léčbě s risperidonem občas kombinují, některá antipsychotika (kupř. chlorpromazin, haloperidol), antidepresiva (fluoxetin, paroxetin, bupropion, klomipramin, imipramin, citalopram a fluvoxamin - poslední dva jmenované jako slabé inhibitory), ale i jiné látky. Podrobnější seznam inhibitorů CYP2D6 včetně jejich účinku je uveden v tab. 2.
Dle většiny zdrojů není možné, na rozdíl od některých jiných isoenzymů CYP, aktivitu CYP2D6 zvýšit induktory,5 výjimečně se uvádí možná indukce rifampicinem a dextromethorfanem.6
Možnosti vyšetřování genotypu
Díky znalostem o vztahu genotypu a fenotypu CYP2D6 lze funkci enzymu odhadnout genotypizací.
V minulosti užívané metody - analýza restrikčních fragmentů (RFLP) s následným Southernovým přenosem a metoda jednovláknového konformačního polymorfismu (SSCP) - jsou v současnosti nedostatečně specifické. Pro rychlou identifikaci lze použít alelově specifickou polymerázovou reakci (AS-PCR), jejíž výhodou je minimální riziko kontaminace a vyloučení falešně negativních výsledků.7 Pro detekci velkých genových delecí a duplikací a pro detekci hybridních genů a strukturních přestaveb slouží long range PCR.8
Mezi moderní metody DNA diagnostiky patří PCR v reálném čase, při níž jsou detekovány významné polymorfismy nulových alel *3, *4, *6, *7 a *8 pomocí fluorescenčně značených sond.9 Nejvýznamnější detekční metodou je sekvenování, které zachytí všechny sekvenční změny ve sledovaných úsecích díky jeho vysoké spolehlivosti a citlivosti. Sekvenování je považováno za referenční metodu, která již nevyžaduje kontrolní materiál. Jinou obdobou sekvenování je pyrosekvenování založené na detekci uvolňovaného pyrofosfátu.10
V posledních letech se stává genetické testování dostupnější díky novým technologiím, jako jsou DNA mikročipy (DNA microarrays), kupř. CYP450 GeneChip a novější AmpliChip CYP450, jejichž podstatou je hybridizace na skleněném "mikročipu" s fluorescenčním značením a které umožňují testování tisíců vzorků současně.11 Jedním z prvních kandidátů pro využití této technologie v praxi je právě gen pro CYP2D6.12 Výhodou je rychlost a spolehlivost metody, nevýhodou její finanční náročnost. V současnosti užívané DNA mikročipy jsou schopny testovat stovky SNP z mnoha genů. AmpliChip CYP450 je první takový mikročip, který byl schválen FDA pro klinické využití v USA v lednu 2005.11 Při úrovni současných znalostí o dopadu polymorfismu různých genů však zatím není možné na základě genetického testování přistoupit k předepisování léků "pacientovi na míru". Tato technologie může nalézt své uplatnění v identifikaci pacientů, pro něž může být daný lék nebezpečný, nebo může vést k úpravě dávkování.2
Možnosti vyšetřování fenotypu
Vzhledem k výše uvedenému - tedy možnosti ovlivnit funkci CYP2D6 jinými látkami - existuje možnost, že fenotyp odhadnutý pomocí genotypizace a skutečná aktivita enzymu se mohou lišit. V těchto situacích se jeví výhodná možnost stanovit fenotyp CYP2D6 přímo.
Stanovením fenotypu je možné zjistit aktuální stav biotransformačních procesů - tedy sumu efektů vnitřního i zevního prostředí v konkrétním čase. Nejběžnějším způsobem zjištění metabolické aktivity vybrané isoformy CYP je sledování metabolismu selektivního markeru, tj. látky, která se v ideálním případě metabolizuje výhradně danou isoformou. Způsob metabolizace léčiva neboli příslušnost k fenotypu je určena stanovením poměru koncentrací mateřského léčiva a jeho metabolitu v krvi nebo moči. Tento parametr se nazývá "metabolický poměr" ("metabolic ratio"). Ideální marker by měla být látka bezpečná s ohledem na její použití in vivo, měla by také být snadno dostupná a snadno stanovitelná v biologických vzorcích (včetně hlavních metabolitu). Farmakokinetika ideálního markeru je určena především jeho metabolizací (nikoli vylučováním látky v nezměněné podobě).13 Sledováním úbytku koncentrace mateřské látky a nárůstu koncentrace metabolitu tak můžeme usoudit na metabolickou aktivitu dané isoformy a případně příslušnosti jedince ke skupině fenotypu (PM, IM, EM, UM). Stejný princip je již také v současnosti využíván při vývoji léčiv, kde se rutinně provádí testování vlivu léčiva na isoformy CYP ještě před uvedením na trh.3 Pro sledování fenotypu CYP2D6 je používána markerová reakce - O-demethylace dextromethorfanu na dextrorfan (tzv. dextromethorfanový test). Pacientům je podáno perorálně 30 mg dextromethorfanu a v séru pacientů 3 hodiny po podání pak jsou stanoveny koncentrace mateřské látky (dextromethorfanu, DEM) i metabolitu (dextrorfanu, DOR).
RISPERIDON A JEHO METABOLIT
Obecně o risperidonu
Risperidon je dle současných vodítek lékem první volby u schizofrenie. Jedná se o antipsychotikum patřící mezi deriváty benzisoxazolu. Risperidon je selektivní mono-aminergní antagonista s vysokou afinitou k 5HT2, D2, alfa1, alfa2 adrenergním a H1 histaminergním receptorům. Risperidon je rovněž antagonistou jiných receptoru, na které se však váže s nižší afinitou; má nízkou až střední afinitu k 5HT1C a 5HT1D a 5HT1A receptorům a nízkou afinitu k D1 dopaminergním receptorům. Risperidon vykazuje nulovou afinitu k muskarinovým a beta1 a beta2 adrenergním receptorům.14
Risperidon je rovněž substrátem pro p-glykoprotein,5 což je membránový transportní protein ovlivňující prostup xenobiotik skrz hematoencefalickou bariéru (viz níže).
Metabolismus risperidonu
Hlavní cestou metabolizace risperidonu je 9-hydroxylace odehrávající se především v játrech. Minoritní cestou je N-dealkylace.14 9-hydroxylaci risperidonu katalyzuje predominantně CYP2D6, přičemž vznikají dva enantiomery (+)-9-OH-risperidon a (-)-9-OH-risperidon.5 Existují údaje napovídající, že na tvorbě 9-OH-risperidonu se podílí rovněž CYP3A4; usuzuje se tak pro změny v koncentraci risperidonu a 9-OH-risperidonu po podání inhibitorů a induktorů CYP3A4.5 Risperidon neinhibuje CYP1A2, CYP2C9, CYP2C19 ani CYP3A4, jeho mírná inhibice CYP2D6 je při terapeutických dávkách risperidonu pravděpodobně klinicky nevýznamná.14 Risperidon a jeho metabolity jsou eliminovány močí a v malé míře faeces.14
Rozdíly mezi risperidonem a jeho metabolitem
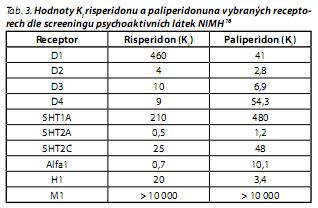
Hlavní metabolit risperidonu 9-OH-risperidon dal vznik samostatně užívanému antipsychotiku paliperidonu. Přípravek Invega obsahuje směs obou enantiomerů, které mají shodné vlastnosti a shodnou farmakodynamickou aktivitu.15 Dle údaje výrobce je paliperidon antagonistou D2 a 5HT2A receptoru, stejně jako antagonista alfa1 a alfa2 adrenergních receptoru a H1 receptoru, přičemž nemá afinitu k cholinergním ani beta adrenergním receptorům.15 Takto popsaný farmakodynamický profil se výrazně neliší od farmakodynamického profilu risperidonu. Existují však údaje o tom, že se tyto dvě látky ve svém účinku přece jen liší. Údaje v databázi Programu screeningu psychoaktivních léků NIMH napovídají, že risperidon má vyšší afinitu k 5HT2A, alfa1 a alfa2 adrenergním receptorům.16 V tab. 3 jsou hodnoty IQ risperidonu a paliperidonu na některých receptorech.
Z dalších zdrojů je pak patrné, že paliperidon má delší biologický poločas a podstupuje pouze omezenou jaterní metabolizaci CYP2D6 a 3A4, 59% dávky paliperidonu je vyloučeno v nezměněné formě ledvinami.15
Jedním z nejdůležitějších rozdílů 9-OH-risperidonu oproti risperidonu je prostup skrz hematoencefalickou bariéru. Dle provedených analýz se jeví, že risperidon prostupuje hematoencefalickou bariérou snadněji než 9-OH-risperidon.17 Tento fakt lze vysvětlit odlišnou afinitou obou látek k p-glykoproteinu. P-glykoprotein je ATP-dependentní efluxní pumpa, která se vyvinula v různých tkáních jako mechanismus protekce před xenobiotiky P-glykoprotein se za fyziologických podmínek nachází v tenkém střevě, ledvinách a rovněž v hematoencefalické bariéře.5 V hematoencefalické bariéře se tento transportér uplatňuje v regulaci prostupu látek skrz bariéru. P-glykoprotein má vyšší afinitu k 9-OH-risperidonu než k risperidonu,17 to znamená, že je přečerpáván skrz hematoencefalickou bariéru zpět do krevního oběhu intenzivněji.
Díky zmíněným údajům je zřejmé, že risperidon a 9-OH-risperidon nejsou shodné molekuly s jediným rozdílem v přítomnosti či nepřítomnosti významné jaterní metabolizace, ale že se obě látky liší jak ve svých farmakokinetických, tak farmakodynamických vlastnostech, a tedy pravděpodobně i v účinnosti a profilu nežádoucích účinků.18
DŮSLEDKY INTERINDIVIDUÁLNÍ VARIABILITY
Jak již bylo řečeno - hlavní enzym metabolizující risperidon je vysoce polymorfní a podmiňuje tak interindividuální variabilitu v metabolismu risperidonu. Tato skutečnost má několik důsledků:
Rozdílné plazmatické hladiny
Laboratorně zjistitelným důsledkem rozdílného fenotypu CYP2D6 jsou rozdílné plazmatické hladiny risperidonu a 9-OH-risperidonu, resp. rozdílnýpoměr risperidon/9-OH-risperidon.19,20,21 Poměr je nejvyšší u PM a nejnižší u UM.20 To znamená, že u pomalých metabolizátorů byla větší frakce risperidonu než u IM, EM a UM. Aktuální fenotyp predikoval poměr risperidon/9-OH-risperidon daleko lépe než genotyp.21 To znamená, že environmentálni faktory, v tomto případě podávání inhibitorů CYP2D6, měly svůj význam. Podání inhibitorů mělo nejmenší dopad u PM, zatímco u ostatních subjektů vzrostl poměr ve prospěch risperidonu výrazně - aktivita CYP2D6 se snížila.20
CYP2D6 se pravděpodobně podílí také na metabolizaci 9-OH-risperidonu. Ve studii na zdravých dobrovolnících bylo při současném užití paliperidonu a paroxetinu (inhibitor CYP2D6) patrné zvýšení plazmatické hladiny paliperidonu v průměru o 16 %.15
Teoretické klinické rozdíly
Pokud je u pacientů s různým fenotypem CYP2D6 různý poměr risperidonu a 9-OH-risperidonu při terapii risperidonem, a risperidon a paliperidon mají odlišné vlastnosti, lze předpokládat i rozdílnou účinnost risperidonu u různých metabolizátorů.
U pomalých metabolizátorů lze teoreticky očekávat minimální metabolizaci, a tedy i vyšší poměr risperidonu, který proniká hematoencefalickou bariérou snadněji než 9-OH-risperidon. Hladina aktivní látky by tak byla v mozku vyšší. Proto lze očekávat vyšší účinnost risperidonu při standardní dávce a vyšší závažnost nežádoucích účinků. U PM bude rovněž metabolismus risperidonu pravděpodobně více závislý na alternativních cestách metabolizace, zejména na CYP3 A4.
Tento efekt se v menší míře projevuje také u IM. Dále je pak u intermediárních metabolizátorů nutná obezřetnost při užívání inhibitorů CYP2D6, které mohou IM změnit fenotypicky na PM se všemi důsledky z toho vyplývajícími.
U ultra-rychlých metabolizátorů pak můžeme očekávat nižší poměr risperidon/9-OH-risperidon. Velká část risperidonu bude tedy metabolizována na 9-OH-risperidon, který hůře prochází skrz hematoencefalickou bariéru, a lze tedy očekávat nižší účinnost risperidonu na příznaky schizofrenie.
Studie CYP2D6 při léčbě risperidonem
V průběhu uplynulých let se mnoho autorů pokoušelo zjistit vztah mezi aktivitou CYP2D6 a terapeutickou odpovědí pacientů na léčbu risperidonem. Údaje z literatury jsou rozporné.
Studie výrobce risperidonu předpokládaly, že risperidon a 9-OH-risperidon mají shodné farmakodynamické a farmakokinetické vlastnosti.22 Toto tvrzení vycházelo ze studie, ve které byl měřen nárůst prolaktinu po jedné dávce risperidonu u zdravých dobrovolníků zahrnujících pouze 11 PM.19 Účinnost risperidonu by dle tohoto předpokladu závisela na aktivní frakci, tedy součtu koncentrací risperidonu a 9-OH-risperidonu. Variabilita CYP2D6 by při léčbě risperidonem potom ztrácela na významu. Užití jedné dávky u zdravých dobrovolníků lze však jen obtížně srovnávat s běžnou klinickou praxí.
V pilotní studii metabolismu risperidonu mělo všech pět identifikovaných PM nežádoucí účinky risperidonu, zatímco poměr pacientů s nežádoucími účinky byl u EM nižší.23
V následujících letech bylo provedeno několik dalších studií, které nenalezly souvislost mezi aktivitou CYP2D6 a účinností a snášenlivostí risperidonu,24,25, 26,27 i když studie měřící plazmatické hladiny risperidonu a jeho hlavního metabolitu vesměs potvrdily závislost tohoto poměru na aktivitě CYP2D6.24,25 Rovněž japonská studie na 136 pacientech nenalezla vztah mezi alelami CYP2D6*4, CYP2D6*10 a klinickým výsledkem při léčbě risperidonem, u této studie však byl sledován pouze výskyt dvou výše zmíněných alel a nebyl sledován fenotyp.28
Na druhou stranu mimo již zmiňované pilotní studie metabolismu risperidonu23 existují i další zprávy, které prokazují význam variability CYP2D6 při léčbě risperidonem. Ve dvou kazuistických sděleních byla konstatována nutnost vyšší dávky pro udržení účinnosti risperidonu u UM.29,30 Rovněž existuje kazuistické sdělení, popisující vznik závažných extrapyramidových nežádoucích účinků při léčbě risperidonem u PM.31 V jedné studii na 35 pacientech bylo sledováno signifikantní prodloužení QTc u pacientů s jednou funkční alelou pro CYP2D6 na rozdíl od pacientů se dvěma funkčními alelami.32 Ve studii na 25 dětech s diagnózou pervazivních vývojových poruch léčených risperidonem byla nalezena pozitivní korelace počtu funkčních alel pro CYP2D6 a plazmatických koncentrací prolaktinu.33
Ve velké deLeonově studii zaměřené na účinnost a snášenlivost risperidonu v závislosti na variabilitě CYP2D6 bylo zařazeno 360 pacientů léčených risperidonem a 252 pacientů, kterým byl risperidon z nejrůznějších důvodů vysazen. PM měli v této studii více než trojnásobné riziko závažných nežádoucích účinků risperidonu (OR = 3,4) a až šestinásobné riziko (OR = 6,0) ukončení léčby risperidonem pro závažné nežádoucí účinky.12 Dle jiných zdrojů je fenotyp PM příčinou 16 % nežádoucích účinků při léčbě risperidonem a 9 % všech ukončení léčby risperidonem.11
Většina studií se zabývala pouze klinickým dopadem extrémních fenotypu (UM, resp. PM) a problematika IM byla sledována zejména z farmakokinetického hlediska. Ze to nemusí být přístup zcela opodstatněný, ukázala studie Laiky z roku 2009.34 Do této studie byli zařazeni pacienti léčení pro psychotické i afektivní poruchy, užívající antidepresiva nebo antipsychotika. Bohužel ani jeden pacient neužíval risperidon. Výsledky této studie však napovídají, že fenotyp IM může být klinicky významný, proto je zmiňován i na tomto místě. IM měli v této studii nižší pravděpodobnost odpovědi na léčbu substráty CYP2D6 a vyšší pravděpodobnost odpovědi na léčbu léky CYP2D6 nemetabolizovanými. IM léčení vyššími dávkami substrátů CYP2D6 měli signifikantně více NÚ než IM léčení nižšími dávkami, EM léčení substráty CYP2D6 i IM léčení léky nemetabolizovanými CYP2D6. A konečně u IM nižší dávka nesnižovala pravděpodobnost, že pacient bude respondér. Dle Laiky jsou tato zjištění o to závažnější, že v posledních letech se díky objevu alely CYP2D6*41 dle některých zdrojů předpokládá, že v evropské populaci je IM asi 30-40 %.34
Farmakoekonomika a cost-effectiveness
Naskýtá se otázka, jestli je testování aktivity CYP2D6 u pacientů se schizofrenií při současné ceně dostupných testů ekonomicky výhodné. V literatuře existuje pouze málo analýz na toto téma.
Fleemanova metaanalýza a review:4 Fleeman et al. se ve svém rozsáhlém přehledu a metaanalýze zabývali rovněž otázkou klinické a ekonomické výhodnosti genotypizace CYP2D6. V literatuře do roku 2008 byla nalezena jen jediná farmakoekonomická studie, která se navíc týkala pouze testování CYP2D6 při užívání antidepresiv. Fleeman svou ekonomickou analýzu uzavírá tvrzením, že nedostatek údajů zatím neumožňuje jednoznačně určit ekonomickou výhodnost testování CYP2D6 u pacientů trpících schizofrenií ani vůbec zkonstruovat ekonomický model potenciálního rutinního testování. Při současné ceně testů by však stačilo prokázat zisk 0,01 QALY (Quality Adjusted Life Years), aby takové testování dosáhlo současně přijímaného standardu ekonomické výhodnosti. Fleeman proto doporučuje provést další studie, které by měly poskytovat údaje o senzitivitě a specificitě použitých testů a poskytnout úplná data ohledně genotypů pacientů. Zejména je pak nutné získat další důkazy, které by lépe objasnily vztah mezi genotypem a fenotypem CYP, další studie by dále měly brát v potaz také environmentálni faktory, jako je konkomitantní medikace a kouření.
Studie Rodriguez-Antony 2009:35 Nejnovější studie Institutu prospektivních technologických studií (JRC-IPTS) při Evropské komisi, jež získala data od pacientů užívajících risperidon v Německu, Španělsku a USA, sice prokázala, že PM mají vyšší riziko výskytu závažných nežádoucích účinků, dále však bylo zjištěno, že k důkladné farmakoekonomické analýze testování CYP2D6 není dostatečné množství klinických a ekonomických dat týkajících se nežádoucích účinků risperidonu, a doporučuje se další provádění zejména prospektivních studií.
Z výše uvedeného vyplývá, že o ekonomické výhodnosti či nevýhodnosti testování CYP2D6 u pacientů se schizofrenií v současnosti není dostatečné množství údajů a bude třeba ještě dalšího výzkumu.
Doporučení pro praxi
V současné době neexistuje dostatek údajů, které by ospravedlnily rutinní užívání testování CYP2D6 u všech pacientů před nasazením risperidonu. Toto testování může nalézt své místo u pacientů s výraznými nežádoucími účinky nebo nedostatečnou účinností risperidonu. Nelze také pominout fakt, že s narůstající dostupností genetického testování může být u některých pacientů genotyp CYP2D6 znám díky vyšetření provedenému v minulosti z indikace lékaře jiné odbornosti.
Zejména na základě dat ze své největší studie12 a na základě klinické zkušenosti deLeon navrhl doporučení pro praxi týkající se dávkování risperidonu. Obecně u prokázaných PM navrhuje snížit dávkování risperidonu na poloviční dávku - u průměrného dospělého PM by tak úvodní dávka byla 0,5-1 mg risperidonu pro die, průměrná dávka 2 mg a maximální 3 mg pro die. V případě současného podávání inhibitorů CYP2D6 navrhuje vydělit dávku koeficientem 1,3. U průměrného dospělého by pak při současném užívání inhibitorů byla úvodní dávka 0,75 - 1,5 mg pro die, průměrná dávka 3 mg pro die a maximální dávka 4 mg pro die. V případě současného podávání fluoxetinu pak navrhuje užívat dávkování, jako by byl pacient PM.5
Laika pak dle výsledků výše citované studie doporučuje rozdílnou strategii při nonresponzi na substráty CYP2D6 u EM a IM. U EM doporučuje navýšení dávky medikace, zatímco u IM doporučuje raději změnu medikace za lék CYP2D6 nemetabolizovaný. U IM totiž ani nízká dávka substrátu CYP2D6 nesnižovala pravděpodobnost pozitivní léčebné odpovědi.34
Naskýtá se otázka, proč u pacientů neužít místo risperidonu přímo paliperidon a minimalizovat tak dopad variability CYP2D6. Jak bylo zmíněno, mezi risperidonem a paliperidonem existuje více rozdílů než jen rozsah, v jakém jsou tyto látky metabolizovány CYP2D6, a není vyloučeno, že jejich účinnost a profil nežádoucích účinků bude jiný. Účinnost a snášenlivost risperidonu je lépe prozkoumaná díky tomu, že je tato látka na trhu mnohem déle než paliperidon. Je rovněž pravděpodobné, že léčebná odpovědna paliperidon je díky vyšší afinitě 9-OH-risperidonu k p-glykoproteinu mnohem více ovlivněna interindividuální variabilitou p-glykoproteinu, o níž existuje ještě méně údajů než o variabilitě v CYP2D6. Užití paliperidonu místo risperidonu dále komplikují v současnosti jasně definovaná preskripční omezení. Paliperidon tedy nemůže být vnímán jako "náhrada" risperidonu s výhodou obcházení jaterního metabolismu, ale jako odlišné antipsychotikum.
ZÁVĚR
Farmakogenetika představuje nadějnou cestu, jak predikovat odpověď pacientů na léčbu, a je tedy prvním krokem k preskripci léků pacientovi "na míru". Testování genotypu a fenotypu je mnohem lépe prozkoumáno na úrovni farmakokinetické - to znamená na úrovni enzymů metabolizujících léčiva. Jak bylo ukázáno na příkladu CYP2D6 a risperidonu, k tomu, aby bylo farmakogenetické testování enzymů metabolizujících léčiva možné, musí být nejprve identifikován vztah mezi genotypem a fenotypem, musí být prokázáno, že se zvažované léčivo a jeho metabolit ve svých vlastnostech liší a že se liší jejich plazmatické hladiny u jedinců s různým fenotypem. Tyto předpoklady je pak nutno ověřit v řadě klinických studií. Jako poslední krok musejí být vyvinuty dostatečně levné a efektivní metody ke stanovení genotypu, jež umožní zavedení farmakogenetického testování do praxe.
U CYP2D6 a risperidonu již existuje dobře definovaný vztah mezi genotypem a fenotypem. Bylo rovněž prokázáno, že se u různých jedinců liší poměr risperidonu a jeho metabolitu 9-OH-risperidonu v krvi. Přes prvotní opačné zprávy bylo později prokázáno, že risperidon a jeho metabolit mají odlišné vlastnosti, a pravděpodobně tedy i účinnost a profil nežádoucích účinků. Studie, které měly potvrdit předpoklad, že se účinnost a snášenlivost risperidonu u jedinců s různým fenotypem liší, přinesly zatím rozporuplné výsledky. Předložené důkazy však již vedly k prvním doporučením k úpravě dávkování léčiv u pacientů s různým fenotypem CYP2D6. Farmakogenetické testování se v poslední době stává finančně mnohem dostupnějším díky zavádění technologií, jako jsou DNA mikročipy. Díky tomu se rovněž snižuje nutný benefit, aby bylo ekonomicky přínosné jej plošně zavést do praxe. Bude však nutno provést další, zejména prospektivní a farmakoekonomické studie, než bude možné farmakogenetické testování CYP2D6 u pacientů léčených risperidonem zavést do rutinní praxe.
LITERATURA
- 1. Arranz MJ, de Leon J. Pharmacogenetics and pharmacogenomics of schizophrenia: a review of last decade of research. Mol Psychiatry 2007; 12 (8) : 707-747.
- 2. de Leon J, Armstrong SC, Cozza KL. Clinical guidelines for psychiatrists for the use of pharmacogenetic testing for CYP450 2D6 and CYP450 2C19. Psychosomatics 2006; 47 (1): 75-85.
- 3. Zlokarnik G, Grootenhuis PD, Watson JB, High throughput P450 inhibition screens in early drug discovery. Drug Discov Today 2005; 10 (21): 1443-1450.
- 4. Fleeman N, McLeod C, Bagust A et al. The clinical effectiveness and cost-effectiveness of testing for cytochrome P450 polymorphisms in patients with schizophrenia treated with antipsychotics: a systematic review and economic evaluation. Health Technol Assess 2010; 14 (3): 1-157.
- 5. de Leon J, Sandson NB, Cozza KL. A preliminary attempt to personalize risperidone dosing using drug-drug interactions and genetics: part II. Psy-chosomatics 2008; 49 (4): 347-361.
- 6. Indiana University Department of Medicine: Division of Clinical Pharmacology [online]. 2010 [cit. 2010-09-12]. P450 Drug interaction table. Dostupné z WWW: http://medicine.iupui.edu/clinpharm/ddis/table.aspx
- 7. Heim M, Meyer UA. Genotyping of poor metabolisers of debrisoquine by allele-specific PCR amplification. Lancet 1990; 336 (8714): 529-532.
- 8. Sachse C, Brockmoller J, Bauer S, Roots I. Cytochrome P450 2D6 variants in a Caucasian population: allele frequencies and phenotypic consequences. Am J Hum Genet 1997; 60 (2): 284-295.
- 9. Stamer UM, Bayerer B, Wolf A, Hoeft A, Stuber F. Rapid and reliable method for cytochrome P450 2D6 genotyping. Clin Chem 2002; 48 (9): 1412-1417.
- 10. L. Zackrisson and B. Lindblom. Identification of CYP2D6 alleles by single nucleotide polymorphism analysis using pyrosequencing. Eur J Clin Pharmacol 2003; 59 (7): 521-526.
- 11. de Leon J, Sušce MT, Murray-Carmichael E. The AmpliChip CYP450 genotyping test: Integrating a new clinical tool. Mol Diagn Ther 2006; 10 (3): 135-151.
- 12. de Leon J, Susce MT, Pan RM et al. The CYP2D6 poor metabolizer phenotype may be associated with risperidone adverse drug reactions and discontinuation. J Clin Psychiatry 2005; 66 (1): 15-27.
- 13. Pelkonen O, Maenpaa J, Taavitsainen P, Rautio A, Raunio H. Inhibition and induction of human cytochrome P450 (CYP) enzymes. Xenobiotica 1998; 28 (12): 1203-1253.
- 14. Janssen Pharmaceuticals. Risperdal. Prescribing information, 2003.
- 15. Ortho-McNeil-Janssen Pharmaceuticals. Invega, highlights of prescribing information, 2007.
- 16. NIMH Psychoactive Drug Screening Program [online]. 2009 [cit. 2010-09-12]. Dostupné z WWW: http://pdsp.med.unc.edu.
- 17. Wang JS, Ruan Y, Taylor RM et al. The brain entry of risperidone and 9-hydroxyrisperidone is greatly limited by P-glycoprotein. Int J Neuropsychopharmacol 2004; 7 (4): 415-419.
- 18. de Leon J, Wynn G, Sandson NB. The pharmacokinetics of paliperidone versus risperidone. Psychosomatics 2010; 51(1): 80-88.
- 19. Huang ML, Van Peer A, Woestenborghs R et al. Pharmacokinetics of the novel antipsychotic agent risperidone and the prolactin response in healthy subjects. Clin Pharmacol 1993; Ther, 54 (3): 257-268.
- 20. de Leon J, Susce MT, Pan RM, Wedlund PJ, Orrego ML, Diaz FJ. A study of genetic (CYP2D6 and ABCB1) and environmental (drug inhibitors and inducers) variables that may influence plasma risperidone levels. Pharmacopsychiatry 2007; 40 (3): 93-102.
- 21. Berecz R, Llerena A, de la Rubia A et al. Relationship between risperidone and 9-hydroxy-risperidone plasma concentrations and CYP2D6 enzyme activity in psychiatric patients. Pharmacopsychiatry 2002; 35 (6): 231-234.
- 22. Megens AA, Awouters FH, Schotte A et al. Survey on the pharmacodynamics of the new antipsychotic risperidone. Psychopharmacology (Berl) 1994; 114(1): 9-23.
- 23. Bork JA, Rogers T, Wedlund PJ, de Leon J. A pilot study on risperidone metabolism: the role of cytochromes P450 2D6 and 3A. J Clin Psychiatry 1999; 60 (7): 469-476.
- 24. Olesen OV, Licht RW, Thomsen E et al. Serum concentrations and side effects in psychiatric patients during risperidone therapy. Ther Drug Monit 1998; 20 (4): 380-384.
- 25. Scordo MG, Spina E, Facciola G et al. Cytochrome P450 2D6 genotype and steady state plasma levels of risperidone and 9-hydroxyrisperidone. Psychopharmacology (Berl) 1999; 147(3): 300-305.
- 26. Plesnicar BK, Zalar B, Breskvar K, Dolzan V. The influence of the CYP2D6 polymorphism on psychopathological and extrapyramidal symptoms in the patients on long-term antipsychotic treatment. J Psychopharmacol 2006; 20 (6): 829-833.
- 27. Roh HK, Kim CE, Chung WG, Park CS, Svensson JO, Bertilsson L. Risperidone metabolism in relation to CYP2D6T0 allele in Korean schizophrenic patients. Eur J Clin Pharmacol 2001; 57 (9): 671-675.
- 28. Kakihara S, Yoshimura R, Shinkai K et al. Prediction of response to risperidone treatment with respect to plasma concencentrations of risperidone, catecholamine metabolites, and polymorphism of cytochrome P450 2D6. Int Clin Psychopharmacol 2005; 20 (2): 71-78.
- 29. Albrecht A, Morena PG, Baumann P, Eap CB. High dose of depot risperidone in a nonresponder schizophrenic patient. J Clin Psychopharmacol 2004; 24 (6): 673-674.
- 30. Guzey C, Aamo T, Spigset O. Risperidone metabolism and the impact of being a cytochrome P450 2D6 ultra-rapid metabolizer. J Clin Psychiatry 2000; 61 (8): 600-601.
- 31. Kohnke D, Griese EU, Stosser D, Gaertner I, Barth G. Cytochrome P450 2D6 deficiency and its clinical relevance in a patient treated with risperidone. Pharmacopsychiatry 2002; 35 (3): 116-118.
- 32. Llerena A, Berecz R, Dorado P, de la Rubia A. QTc interval, CYP2D6 and CYP2C9 genotypes and risperidone plasma concentrations. J Psychopharmacol 2004; 18(2): 189-193.
- 33. Troost PW, Lahuis BE, Hermans MH et al. Prolactin release in children treated with risperidone: impact and role of CYP2D6 metabolism. J Clin Psychopharmacol 2007; 27 (1): 52-57.
- 34. Laika B, Leucht S, Heres S, Steimer W Intermediate metabolizer: increased side effects in psychoactive drug therapy. The key to cost-effectiveness of pretreatment CYP2D6 screening? Pharmacogenomics J 2009; 9 (6): 395-403.
- 35. Rodriguez-Antona C, Gurwitz D, de Leon J et al. CYP2D6 genotyping for psychiatric patients treated with risperidone: considerations for cost-effectiveness studies. Pharmacogenomics 2009; 10 (4): 685-99.





