Česká a slovenská psychiatrie

Časopis
Psychiatrické společnosti ČLS JEP
a Psychiatrickej spoločnosti SLS
souborný článek / review article
KANABINOIDY, ENDOKANABINOIDNÍ SYSTÉM A TERAPIE VYBRANÝCH PORUCH ÚZKOSTNÉHO SPEKTRA
CANNABINOIDS, ENDOCANNABINOID SYSTEM AND THERAPY OF ANXIETY DISORDERS
Petr John1,2, Jan Juřica1,3,4
1 LF MU, Brno
2 CZECRIN
3 FaF MU, Brno
4 MOÚ, Brno
2 CZECRIN
3 FaF MU, Brno
4 MOÚ, Brno
Příspěvek byl zpracován s podporou Specifického vysokoškolského výzkumu poskytovanou MŠMT (Ministerstvo školství, mládeže a tělovýchovy ČR) MUNI/A/1342/2022.
SOUHRN
John P, Juřica J. Kanabinoidy, endokanabinoidní systém a terapie vybraných poruch úzkostného spektra
Cíl: Při vývoji nových anxiolytik je slibným terapeutickým cílem endokanabinoidní systém (ECS) především díky své schopnosti modulace synaptické plasticity a schopnosti retrográdně regulovat ostatní neurotransmiterové systémy. Farmakologicky lze cílit agonisticky a antagonisticky na receptory CB1 a CB2, případně inhibičně na enzymy FAAH a MAGL, které se podílejí na degradaci endokanabinoidů. Cílem tohoto sdělení je podat ucelený systematický přehled o klinickém využití endokanabinoid-ního systému jako farmakoterapeutického cíle u poruch úzkostného spektra (posttraumatická stresová porucha, generalizovaná úzkostná porucha, sociální fobie a panická porucha).
Metoda: V květnu 2023 bylo provedeno systematické vyhledávání v databázích Medline (PubMed) a Web of Science (WOS). Byla použita klíčová slova "(cannabinoid* OR endocannabinoid* OR cannabidiol* OR tetrahydrocannabinol*) AND ((PTSD OR posttraumatic stress disorder) OR (GAD OR generalized anxiety disorder) OR (PA OR panic attack) OR (SAD OR social anxiety disorder))" v polích "Title OR Abstract". Mezi vylučovací kritéria patřily publikace psané v jiném jazyce než v anglickém, publikace jednotlivých kazuistik, konferenční abstrakta a preklinické studie. Do přehledového článku tak byly zařazeny prospektivní, retrospektivní, randomizované kontrolované studie, v nichž byly použity stanovené dávky kanabinoidů nebo kombinace ligandů kanabinoidních receptorů.
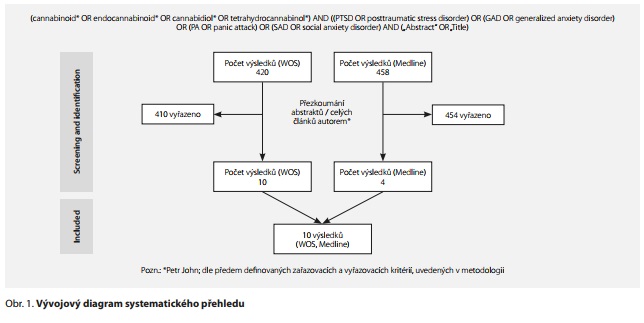
Výsledky: Pomocí databází Medline a Web of Science bylo vyhledáno 420 a 458 publikací, z nichž bylo po přezkoumání vyřazeno 410 a 454 publikací pro nesplnění selekčních kritérií. Do přehledu bylo zařazeno 10 publikací, které se týkaly daného tématu. Bylo publikováno 6 studií, které sledovaly účinnost kanabinoidů v terapii PTSD, další 4 studie se zabývaly využitím kanabinoidů v terapii SAD a GAD. Klinické studie v terapii panické poruchy nebyly dosud provedeny.
Závěr: Na základě výsledků dosud publikovaných klinických studií se ukazuje, že endokanabinoidy jsou v posledních letech testovány v klinických studiích jako alternativní nebo komplementární terapie v indikaci poruch úzkostného spektra, konkrétně PTSD, GAD a SAD. Byly provedeny čtyři randomizované klinické studie, které sledovaly efekt kanabinoidů v terapii SAD, ve kterých se prokázala účinnost kanabidiolu. Ze šesti otevřených nebo retrospektivních studií sledujících účinek kanabinoidů v terapii PTSD prokázal ve třech studiích účinnost nabilon (tetrahydrokanabinol). V dalších třech studiích se účinek prokázal, avšak nebyl statisticky hodnocen/hodnotitelný. Příznivé výsledky studií mohou být ovlivněny nízkým počtem subjektů a u některých studií také absencí kontrolní skupiny. Dále některé studie učinily závěry na základě závislosti efektu na dávce kanabinoidů s využitím neurozobrazovacích metod a subjektivního skóru při hodnocení úzkosti, aniž by byly hodnoceny plazmatické hladiny podávaných kanabinoidů. Přestože tedy dostupná data ukazují na slibný potenciál kanabinoidů v terapii úzkostných poruch, měli bychom z výše uvedených důvodů výsledky interpretovat s opatrností a pro definitivní potvrzení nálezů bude nutné vyčkat na závěry dobře designovaných prospektivních, randomizovaných a kontrolovaných studií.
Klíčová slova: endokanabinoidy, generalizovaná úzkostná porucha, kanabidiol, kanabinoidy, nabilon, posttraumatická stresová porucha, sociální fóbie, tetrahydrokanabinol
SUMMARY
John P, Juřica J. Cannabinoids, endocannabinoid system and therapy of anxiety disorders
Abstract: In the development of novel anxiolytics, the endocannabinoid system (ECS) is a promising therapeutic target primarily due to its ability to modulate synaptic plasticity and to act as a retrograde regulator of several neurotransmitter systems. Pharmacologically, it can target at CB1 and CB2 receptors (agonistitic or antagonistic activity) or by inhibiting FAAH and MAGL enzymes, which are involved in endocannabinoid degradation. The aim of this article is to provide a comprehensive systematic review of the clinical use of the endocannabinoid system as a pharmacotherapeutic target in anxiety spectrum disorders (posttraumatic stress disorder, generalized anxiety disorder, social phobia, and panic disorder).
Method: In May 2023, a systematic search through the Medline (PubMed) and Web of Science (WOS) databases was performed. The keywords used were "(cannabinoid* OR endocannabinoid* OR cannabidiol* OR tetrahydrocannabinol*) AND ((PTSD OR posttraumatic stress disorder) OR (GAD OR generalized anxiety disorder) OR (PA OR panic attack) OR (SAD OR social anxiety disorder))" in the "Title OR Abstract" fields. Exclusion criteria included non-English language records, case reports, conference abstracts, and preclinical studies. Thus, only prospective, retrospective, randomized controlled trials using fixed doses of cannabinoids or combinations of cannabinoid receptor ligands compared with placebo were included in the review article.
Results: Using the Medline and Web of Science databases, 420 and 458 publications respectively were retrieved, of which 410 and 454 were excluded from the review for not meeting the inclusion criteria. Thus, ten publications that were relevant to the topic were included in the review. There were six studies dealing with cannabinoids in the treatment of PTSD and further four studies referring to the use of cannabinoids in the treatment of SAD and GAD. Clinical trials in the treatment of panic disorder have not yet been conducted.
Conclusion: Based on the results of clinical trials published to date, it appears that endocannabinoids have been tested in recent years as an alternative or complementary therapy in the indications of anxiety disorders, particularly PTSD, GAD and SAD. Four randomised clinical trials, which investigated the effect of cannabinoids in the treatment of SAD, found cannabidiol to be effective. Out of the six open-label or retrospective studies evaluating the effect of cannabinoids in the treatment of PTSD, nabilone or tetrahydrocannabinol have demonstrated efficacy in three studies. The remaining three studies showed clinical effect however not statistically significant or assessable. The favourable results of the studies may be affected by the low number of subjects and, in some studies, the absence of a control group. In addition, some studies have drawn conclusions based on the dose-response relationship with the use of measures such as neuroimaging and subjective scores on anxiety assessments, without assessing plasma levels of administered cannabinoids. Thus, although the available data suggest a promising potential for cannabinoids in the treatment of anxiety disorders, we should interpret the results with caution for the reasons mentioned above. Thus to draw evidence-based conclusions for clinical practice, it will be necessary to wait for the results of well-designed prospective, randomized, controlled trials to confirm the findings definitively.
Key words: cannabidiol, cannabinoids, endocannabinoids, generalized anxiety disorder, nabilon, posttraumatic stress disorder, social anxiety disorder, tetrahydrocannabinol
ÚVOD
Poruchy úzkostného spektra
Poruchy úzkostného spektra řadíme do skupiny onemocnění, kdy je úzkost hlavním příznakem a stává se maladaptivní. Při těchto poruchách nemá úzkost racionální opodstatnění a pacient zpravidla neví, z čeho má strach. Úzkost je nepříjemný emoční stav, který je zpravidla doprovázen také vegetativními příznaky, které mají vliv na celkové zdraví pacienta. Pokud úzkost svou četností a intenzivitou přesáhne určitou mez, onemocnění výrazně zasahuje do kvality života. Dle MKN-10 řadíme do poruch úzkostného spektra panickou poruchu, generalizovanou úzkostnou poruchu, smíšenou depresivně úzkostnou poruchu, agorafobii, sociální fobii a specifickou fobii.1 V terapii úzkostných poruch se uplatňují léčiva modulující aktivitu neurotransmiterů dopaminu (DA), serotoninu (5-HT), γ?aminomáselné kyseliny (GABA) na jejich receptorech, popř. ovlivňující jejich zpětné vychytávání nebo degradaci.2 Teoreticky je také možno ovlivnit i jejich syntézu, uvolňování nebo skladování.3 Konkrétně se jedná především o inhibitory zpětného vychytávání 5-HT a norepinefrinu (SSRI, SNRI) a alosterické modulátory GABA receptorů. Při vývoji nových anxiolytik je slibným terapeutickým cílem endokanabinoidní systém především díky své schopnosti modulace synaptické plasticity a schopnosti retrográdně regulovat výše zmíněné neurotransmiterové systémy. Farmakologicky lze cílit agonistickým a antagonistickým působením na receptory CB1 a CB2, případně inhibičně na enzymy FAAH (fatty acid amino hydrolase, hydroláza amidů mastných kyselin) a MAGL (monoacylglycerol lipase, lipáza monoacylglycerolů), které se podílejí na degradaci endokanabinoidů.4
Endokanabinoidní systém
Užívání kanabinoidů obsažených v rostlině Cannabis sativa / Cannabis indica / Cannabis ruderalis pro jejich léčebné, relaxační a náladu zlepšující účinky je doloženo ve většině starověkých civilizací v Evropě a Asii.5 Objev tetrahydrokanabinolu (THC) v 60. letech 20. století odstartoval rozsáhlý výzkum jeho biologických cílů a endogenních ligandů. V pozdější době došlo k objevu dvou kanabinoidních receptorů spolu s endogenním ligandem anandamidem a 2-arachidonoylglycerolem.6 Endokanabinoidní systém (ECS) tedy zahrnuje endogenní kanabinoidy, receptory CB1 a CB2 a biodegradační enzymy endokanabinoidů FAAH a MAGL.7
Přírodní a syntetické kanabinoidy
Kanabinoidy mají své uplatnění v terapii chronické bolesti, chemoterapií indukované nauzey a zvracení, spasticity a s ní spojené bolesti u roztroušené sklerózy, Gilles de la Tourette syndromu, epilepsie, kachexie a v paliativní léčbě a povrchové léčbě dermatóz a slizničních lézí. Konkrétně se jedná o medicinální konopí, kanabidiol, tetrahydroka-nabinol, dronabinol a nabilon.8
Kanabidiol (CBD) je jediným schváleným přírodním kanabinoidem ve Spojených státech amerických pro užití v humánní medicíně. CBD je schváleno v terapii Lennoxova-Gastautova syndromu, syndromu Dravetové a tuberózní sklerózy. Denní dávka CBD v těchto indikacích se pohybuje v rozmezí 5-20 mg/kg. Přesný mechanismus účinku v terapii výše zmíněných indikací není znám. Předpokládá se, že výsledný účinek je zprostředkován antagonistickým působením na CB1 a CB2 receptory.9
Nabilon je schválen jako antiemetikum v terapii nevolnosti vyvolané chemoterapií v případě, kdy selhala terapie první volby. Počáteční dávka nabilonu je 1-2 mg dvakrát denně a lze ji navýšit na 2 mg třikrát denně. Nabilon působí jako parciální agonista na CB1 a CB2 receptorech. Antiemetický efekt je pravděpodobně způsoben účinkem na centrální CB1 receptory.10
Dronabinol jakožto synteticky připravený THC našel své uplatnění v antiemetické terapii, v terapii anorexie u pacientů s diagnostikovaným syndromem získaného selhání imunity (AIDS) a v terapii obstrukční spánkové apnoe. V terapii anorexie se terapeutická denní dávka pohybuje v rozmezí 5-20 mg. Vyšší dávky představují vyšší riziko centrálních nežádoucích účinků (závrať, ospalost, paranoia). Jako antiemetikum je dronabinol podáván ve formě kapslí 1-3 hodiny před podáním chemoterapie v dávce 5 mg/m2 a každé 2-4 hodiny po podání chemoterapie v dávce 5 mg/m.2 V terapii obstrukční spánkové apnoe se dronabinol podává v jedné dávce v rozmezí 2,510 mg hodinu před spaním. Dronabinol má podobnou afinitu k CB1 a CB2 receptorům, avšak výsledný účinek je dán především vazbou na CB1 receptor. Většina účinků (analgezie, zvýšení chuti k jídlu, svalová relaxace), které využíváme v praxi, je zprostředkována právě přes centrálně lokalizované CB1 receptory.11
Mechanismus anxiolytického působení kanabinoidů
Přestože se v minulosti dokonce objevovaly informace o kanabinoidech jako o možném spouštěči úzkostných poruch, zejména v poslední dekádě se uvažuje spíše o ECS jako o možném terapeutickém cíli anxiolytik.12 Mnoho neurobiologických studií se snažilo popsat funkci a roli endokanabinoidního systému v modulaci strachu, úzkosti a nálady. U zdravých dobrovolníků byl zkoumán vliv THC a CBD na náladu a úzkost. Autoři těchto studií se víceméně shodují v tom, že agonisté CB1 receptorů působí bifázicky, přičemž nízké dávky působí anxiolyticky a vysoké dávky anxiogenně.13 Ve studii zkoumající vliv THC (10 mg) a CBD (600 mg) na psychické funkce v jednorázovém podání v porovnání s placebem došlo u 33 % zdravých účastníků, kterým bylo podáno THC, ke zvýšení úzkosti, dysforii, psychotických příznaků a k sedaci. Naopak CBD úzkostné projevy nezhoršilo a ani nevyvolalo.14 Bifázický účinek kanabinoidů byl popsán také v preklinických experimentech na hlodavcích v rámci jejich účinků na exploraci a motorickou aktivitu.15 Další preklinická studie ukázala, že THC a CBD mají opačné účinky na amygdalu, což nakonec potvrzuje i jejich opačné účinky v rámci ovlivnění úzkostných poruch.15,16 Možný mechanismus bifázického působení kanabinoidů je dán tím, že se na anxiolytických a anxiogenních účincích podílejí odlišné typy receptorů a kanabinoidy mají k těmto receptorům různou afinitu, což se pak projeví dávkově odstupňovanými účinky.17
Existuje řada dokladů o propojení endokanabinoidního a opioidního systému. Kanabinoidy nepřímo zesilují analgetické a antidepressive-like účinky opiodů u hlodavců.18 Agonisté kanabinoidních receptorů zvyšují také uvolňování endogenních opioidů.19 Anxiolytický účinek THC je pravděpodobně zprostředkován také μ a σ opiodními receptory. Antagonista μ receptoru β?funaltrexamin a antagonista a receptoru naltrindol antagonizovali anxiolytické působení THC, zatímco antagonista k receptorů norbinatorfimin nerušil anxiolytické účinky THC.20 Aktivace k receptoru může do jisté míry působit anxiogenně.21 Další výsledky z pokusu na myších s knock-outem k receptorů a deficitem dynorfinů ukázaly potlačení motivačních účinků THC a tento možný mechanismus účinku (prostřednictvím dynorfinu a následným ovlivněním opioidních receptorů) potvrdily.22
CB1 receptory je možné nalézt v axonových zakončení GABA inhibičních neuronů. Bylo prokázáno, že agonisté CB1 receptorů snižují uvolňování GABA z presynaptických vezikul.23 Dalším dokladem o propojení těchto dvou neurotransmiterových systémů je, že flumazenil antagonizoval anxiogenní působení THC ve vyšších dávkách a anxiolytické působení CBD. GABAA receptor tak hraje pravděpodobne roli v anxiogenním (vyšší dávky ligandu), ale také anxiolytickém (nižší dávky ligandu) efektu kanabinoidů.24
Role serotoninu v anxiogenezi je velmi komplexní a podílejí se na ní různé podtypy serotoninových receptorů.25 5-HT1A receptory, které hrají v rozvoji úzkostných poruch podstatnou roli, jsou pravděpodobně ovlivněny agonistickým působením ligandy CB1 receptorů, protože kanabinoidy navozená hypotermie je zprostředkována ovlivněním somatodendritických 5-HT1A receptorů.26 Endokanabinoidní systém tedy pravděpodobně ovlivňuje vyplavování serotoninu. Bylo prokázáno, že in vivo aktivace receptorů CB1 inhibuje uvolňování 5-HT v projekčních oblastech neuronů DR (dorsal raphae).27 Antagonistickým působením na receptor CB1 došlo ke zvýšení bazální hladiny serotoninu v mediální prefrontální kůře.28 Aktivací receptorů CB1 dochází dle výše uvedených mechanismů ke sníženému uvolňování serotoninu v CNS, které je regulováno negativní zpětnou vazbou prostřednictvím 5-HT1 receptorů. Endokanabinoidní systém dále hraje roli v expresi a funkci jednotlivých 5-HT receptorů v CNS. Po chronickém podávání agonisty CB1 receptorů WIN 55,212-2 došlo ke zvýšené expresi a funkci 5-HT1A receptorů v hipokampu.29 V další animální studii bylo dosaženo podobných výsledků, kdy docházelo po opakovaném podání agonisty CB1 receptorů HU210 ke zvýšení exprese a funkce 5-HT1A receptorů.30 Iontový kanál spojený s receptory 5-HT3 je dalším farmakologickým cílem, na který někteří agonisté kanabinoidních receptorů působí. Přinejmenším některé účinky kanabinoidů (antiemeze a analgezie) tedy mohou být zprostředkovány touto cestou.31 Podobně je tomu i u 5-HT2 receptorů, které jsou blokovány endokanabinoidy anandamidem a oleamidem.32 Tyto studie společně poskytují přesvědčivé důkazy o tom, že endokanabinoidy prostřednictvím aktivace centrálních receptorů CB1 modulují uvolňování serotoninu i funkci serotoninových receptorů. Taková regulační kontrola může představovat mechanismus, který je základem funkčního vzájemného ovlivňování mezi endokanabinoidním systémem a serotonergním systémem a potenciál pro terapeutické použití kanabinoidů v terapii úzkostných poruch.
Inhibice enzymu FAAH, který se podílí na degradaci anandamidu a dalších endokanabinoidů, vykazuje anxiolytické účinky u dospělých potkanů.33 Stejně tak se anxiolytický účinek prokázal po aplikaci inhibitoru zpětného vychytávání anandamidu N-(4-hydroxyfenyl)-arachidonylamidu (AM 404; současně i agonista TRPV1 receptorů).
Anxiolytický účinek byl v animální studii doprovázen zvýšenou hladinou anandamidu v mozkové tkáni.34 AM 404 v animální studii významně snížil vyplavování kortikosteronu, což naznačuje vztah mezi endokanabinoidním systémem a hypotalamo-adrenokortikotropním systémem.35 Endokanabinoidní systém hraje pravděpodobně roli v regulaci emočního chování také přímo prostřednictvím receptorů CB1. Antagonista CB1 receptorů rimonabant vyvolal při krátkodobém podání potkanům úzkostné projevy.36 Rimonabant byl schválen k terapii obezity v Evropě roku 2006, avšak právě z důvodu otázek ohledně jeho bezpečnosti nebyl v USA nikdy schválen. Z důvodu účinků zahrnujících změny nálad, deprese a sebevražedné sklony byl Evropskou agenturou pro léčivé přípravky nakonec stažen v roce 2008 z trhu. U myší s knock-out kanabinoidního receptoru CB1 bylo pozorováno zvýšení bazální hladiny úzkosti během stresových situací.37 Naopak v jiné studii myši s mutací kódující nefunkční CB1 receptor nevykazovaly fenotypově v shock-probe burying testu úzkostné projevy.38 Je tedy otázkou, jak komplexní je vlastně zapojení ECS do NT systémů a zda lze vůbec hovořit o přímém nebo "čistém" anxiolytickém účinku ligandů kanabinoidních receptorů.
CÍLE A METODY
Cílem tohoto přehledového článku je podat ucelený systematický přehled o klinickém využití endokanabinoidního systému jako farmakoterapeutického cíle u vybraných poruch úzkostného spektra (posttraumatická stresová porucha, generalizovaná úzkostná porucha, sociální fobie a panická porucha).
V květnu 2023 bylo provedeno systematické vyhledávání v databázích Medline (PubMed) a Web of Science (WOS). Byla použita klíčová slova "(cannabinoid* OR endocannabinoid* OR cannabidiol* OR tetrahydrocannabinol*) AND ((PTSD OR posttraumatic stress disorder) OR (GAD OR generalized anxiety disorder) OR (PA OR panic attack) OR (SAD OR social anxiety disorder))" v polích "Title OR Abstract".
Do přehledového článku byly z vyhledaných literárních zdrojů po podrobnějším přezkoumání zařazeny pouze prospektivní a retrospektivní klinické studie, v nichž byly jednotlivé kanabinoidy nebo kombinace ligandů kanabinoidních receptorů hodnoceny na subjektech s diagnostikovanou poruchou úzkostného spektra. Mezi vylučovací kritéria patřily publikace psané v jiném jazyce než v anglickém, publikace jednotlivých kazuistik, konferenční abstrakta a preklinické studie.
VÝSLEDKY
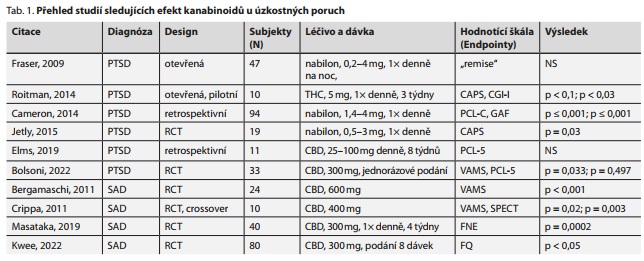
Pomoci databáze Medline (PubMed) a Web of Science bylo vyhledáno 420 a 458 publikací, z nichž bylo po přezkoumání vyřazeno 410 a 454 publikací pro nesplnění selekčních kritérií (Cíle a Metody). Do přehledu bylo tedy zařazeno 10 publikací, které se týkaly daného tématu. Bylo publikováno 6 studií zabývajících se kanabinoidy v terapii PTSD a další 4 studie se zabývaly využitím kanabinoidů v terapii SAD a GAD. Klinické studie v terapii panické poruchy nebyly dosud provedeny. Přehled studií shrnuje tab. 1.
V terapii panické poruchy dosud nebyly provedeny žádné klinické studie sledující použití kanabinoidů.
KANABINOIDY V TERAPII PTSD
Jedna z prvních studií, kdy byl použit syntetický kanabinoid v terapii PTSD, byla provedena v letech 2004-2006. Jednalo se o otevřenou studii, kdy bylo pacientům (n = 47) podáno spolu s konvenční léčbou zkoušené léčivo nabilon. Všichni pacienti trpěli déle než dva roky vedle PTSD také nočními můrami. U 47 pacientů, u nichž byla zachována standardní léčba PTSD, se podávala počáteční dávka 0,5 mg nabilonu a podle účinku byla titrována. Průměrná účinná dávka nabilonu byla 0,5 mg jednu hodinu před spaním, s rozmezím 0,2 mg až 4,0 mg. Délku podání nabilonu studie neuvádí. U 34 pacientů (72 %) došlo k úplnému vymizení nebo zmírnění závažnosti nočních můr a dalších příznaků. U čtyř pacientů po ukončení terapie nabilonem (trvající 4-12 měsíců) nedošlo k relapsu nočních můr (noční můry se nevrátily nebo se vrátily ve snížené míře a nevyžadovaly další farmakoterapii), zatímco u ostatních pacientů došlo po vysazení léčbě nabilonem k recidivě nočních můr (obvykle během prvních dvou nocí). U těchto pacientů došlo ke zlepšení stavu po opětovném zahájením léčby nabilonem. K výsledkům studie je nutné přistupovat s opatrností, jelikož u pacientů byl zkoumán pouze vliv nabilonu na nespavost a noční můry. Vliv na anxietu nebyl zkoumán.39
V otevřené studii z roku 2014 pacienti (n = 10) užívali spolu se standardní terapií perorálně 5 mg THC ve formě oleje po dobu tří týdnů. Pacienti užívali olej sublingválně 2krát denně, hodinu po probuzení a 2 hodiny před ulehnutím. Adjuvantní terapie THC prokázala výrazné zlepšení příznaků PTSD (hodnoceni pomocí škál CAPS - The Clinician-Administered PTSD Scale, CGI - The Clinical Global Impression) u všech pacientů. Došlo k signifikantnímu zlepšení kvality spánku, snížení frekvence nočních můr a dalších hyperexcitačních symptomů (100 %). U dvou pacientů (20 %) došlo k úplné remisi nočních můr. Výsledky této pilotní studie je nutné brát s rezervou vzhledem k nízkému počtu subjektů, avšak tato studie naznačuje dobrý bezpečnostní profil a účinnost v doplňkové terapii chronické PTSD.40
Cameron et al. v retrospektivní kanadské studii hodnotili účinky nabilonu podávaného heterogenní skupině pacientů s psychiatrickým onemocněním (90 % PTSD, n = 94). Medián počáteční dávky byl 1,4 mg denně. Udržovací dávka byla 4 mg denně. Zlepšení symptomů PTSD bylo hodnoceno pomocí skóru PCL (PTSD CheckList). Průměrný skór se po léčbě nabilonem snížil z 54,7 na 38,8 bodu (p < 0,001). Vzhledem k výraznému snížení PCL skóru bylo možné překlasifikovat subjekty s diagnózou středně těžké PTSD na mírnou až hraniční PTSD. U 31 (29,8 %) pacientů se objevily nežádoucí příhody, z nichž nejzávažnější byla psychóza, která se projevila u dvou pacientů (1,9 %) s preexistujícím psychotickým onemocněním v osobní anamnéze. Vyvodit jednoznačný závěr studie není možné vzhledem k určitým limitacím. Především se jedná o retrospektivnost studie a absenci kontrolní skupiny. Nicméně vzhledem k signifikantnímu zlepšení některých příznaků ve velmi krátkém čase můžeme říci, že toto zlepšení lze přičítat účinkům nabilonu.41
Další studie hodnotící účinek nabilonu v terapii PTSD byla provedena na válečných veteránech (n = 19). Jedná se o první dvojitě zaslepenou, placebem kontrolovanou studii s použitím nabilonu. Úvodní dávka nabilonu 0,5 mg byla postupně titrována na účinnou dávku, při které došlo k vymizení nočních můr. Maximální dávka nabilonu byla 3 mg. Pacienti užívali nabilon/placebo každý den před spaním po dobu 7 týdnů. Následovala dvoutýdenní wash-out perioda a crossover obou skupin, kdy opět pacienti po dobu 7 týdnů užívali nabilon/placebo. Redukce příznaků PTSD byla primárně sledována pomocí skóru CAPS. Skupina, které byl podáván nabilon, prokázala výraznější pokles skóru CAPS (3,6 bodu proti 1,0 bodu; p = 0,03). U 50 % pacientů s nabilonem se vyskytly nežádoucí účinky, zatímco nežádoucí účinky ve skupině s placebem se vyskytly u 60 % (sucho v ústech, bolest hlavy). Výsledky studie jsou povzbudivé, avšak významnou limitací je opět nízký počet subjektů. Tato limitace je do jisté míry redukována "cross-over" designem studie.42
Elms et al. publikovali v roce 2018 výsledky retrospektivní studie zkoumající vliv perorálního podávání CBD na příznaky PTSD u 11 dospělých pacientů v ambulanntím režimu. CBD byl podáván v otevřeném, flexibilním dávkovacím režimu pacientům, u nichž psychiatr diagnostikoval PTSD. Pacienti užívali CBD 1-2krát denně dle závažnosti symptomů PTSD. Medián počáteční dávky byl 33,18 mg denně a průměrná dávka po 8 týdnech studie byla 48,64 mg. Pacienti byli souběžně dále léčeni standardními postupy. U 10 pacientů bylo zaznamenáno výrazné zmírnění závažnosti příznaků, což se projevilo nižším skórem PCL. Průměrný PCL skór se snížil po 8 týdnech z 51,82 na 37,14 bodu (28 %). Autoři statistickou signifikanci tohoto poklesu neuvádějí. Výsledky studie je nutné interpretovat s opatrností vzhledem k nízkému počtu subjektů, retrospektivitě studie a absenci kontrolní skupiny. Souběžná psychofarma-koterapie byla v průběhu studie různě modifikována, což mohlo výrazně ovlivnit výsledky studie.43
Do dvojitě zaslepené klinické studie bylo zařazeno 33 pacientů ve věku 18 až 60 let s diagnózou PTSD podle skóru SCID-5 (The Structured Clinical Interview for DSM-5). Pacienti byli náhodně rozděleni do dvou skupin, kdy jedné skupině bylo podáno 300 mg CBD (n = 17) a druhé placebo (n = 16). Hodnocení pomocí škály VAMS (Visual Analogue Mood Scale) týden po podání ukázalo mírnější nárust skóru faktoru kognitivní poruchy, avšak skór VAMS pro úzkost neprokázal po terapii žádný signifikantní rozdíl mezi CBD a placebem (p = 0,497). Nebyly zaznamenány žádné rozdíly ve fyziologických funkcích (tlak krve a srdeční frekvence) mezi oběma skupinami.44
KANABINOIDY V TERAPII GENERALIZOVANÉ ÚZKOSTNÉ PORUCHY (GAD) A SOCIÁLNÍ FOBIE (SAD)
Bergamaschi et al. ve dvojitě zaslepené randomizované studii hodnotili účinky jednorázového perorálního užití 600 mg CBD. Do studie bylo zařazeno 36 subjektů, z nichž 12 bylo zdravých a sloužilo jako kontrolní skupina bez jakékoliv intervence pro sledování fyziologických funkcí. Z 24 pacientů s diagnózou sociální fóbie, kteří nebyli před zařazením do studie nijak léčeni, byly vytvořeny dvě skupiny. Jedna skupina dostala jednu dávku 600 mg CBD a druhá placebo. Hodnocený léčivý přípravek byl podáván 90 minut před vyšetřením. Subjektivní hodnocení pomocí VAMS, SSPS-N (Negative Self-Statements Subscale) a fyziologická měření, jako je krevní tlak, srdeční frekvence a kožní vodivost, byla měřena v 6 různých časových intervalech. Po analýze výsledků studie pomocí hodnoticí škály VAMS se ukázalo, že placebová skupina vykazovala ve srovnání se skupinou CBD významně vyšší úroveň úzkosti s většími kognitivními poruchami. Nebyly zjištěny žádné významné rozdíly v hodnocených fyziologických funkcích obou skupin. Autoři studie interpretují anxiolytické účinky jednorázového podání CBD u pacientů trpících SAD jako uspokojivé s rychlým nástupem. Omezením studie je jistě velikost vzorku, nicméně statistická síla výsledku VAMS a SSPS-N je poměrně výrazná i při malém počtu pacientů.45
Ve dvojitě zaslepené crossover studii byl sledován efekt CBD oproti placebu u pacientů se sociální fobií (SAD - social anxiety disorder, n = 10). Primárním cílem bylo potvrdit potenciální účinnost CBD v terapii SAD. Pro analýzu účinků CBD u těchto pacientů byl hodnocen každý subjekt pomocí VAMS, a sice 30 minut před podáním zkoušeného léčiva, v čase podání léčiva a 75 minut po podání. Ke sledování účinku CBD u pacientů se SAD byla použita i neurozobrazovací metoda SPECT (single-photon emission computed tomography). V první fázi byla subjektům podána dávka 400 mg CBD/placebo. Ve druhé fázi došlo k překřížení skupin se stejnou dávkou. Po analýze skóru VAMS se ukázalo, že akutní podání CBD snižuje subjektivní úzkost u pacientů s klinicky diagnostikovanou SAD. U pacientů užívajících CBD došlo k poklesu o 36,5 % na škále VAMS, což představuje statisticky i klinicky významný rozdíl. Oproti tomu ve skupině s placebem došlo k poklesu skóru na škále VAMS pouze o 10,23 %. Zobrazení SPECT ukázalo, že CBD působí v paralimbických a limbických oblastech.46
Randomizovaná placebem kontrolovaná studie zkoumala vliv CBD u adolescentů s diagnostikovanou SAD (n = 40). Pacienti denně užívali 300 mg CBD/placeba po dobu 4 týdnů. Hodnocení probíhalo pomocí škály FNE (Fear of Negative Evaluation Questionnaire). Tři pacienti byli v průběhu studie vyřazeni, jelikož odmítli pokračovat v léčbě. Průměrný skór FNE byl u CBD skupiny před zahájením léčby 24,4 bodu a po ukončení léčby FNE skór klesl na 19,1 bodu. V případě placeba se jednalo o pokles z 23,5 bodu na 23,3 bodu. Výsledky studie ukazují, že při léčbě CBD došlo k mnohem výraznějšímu poklesu FNE skóru a tím i zlepšení příznaků SAD (p = 0,0002). Lze říci, že výsledky studie poskytují důkazy o anxiolytických účincích opakovaného podávání CBD u dospívajících se SAD. Nicméně je nezbytné tyto předběžné výsledky potvrdit a případně zjistit souvislost efektu s plazmatickými hladinami CBD.47
Ve dvojitě zaslepené, randomizované a placebem kontrolované studii byl hodnocen účinek CBD v podpůrné terapii SAD (n = 80). Pacientům bylo v rámci studie podáno osm dávek 300 mg CBD nebo placebo. Analýza účinků CBD byla měřena pomocí FQ (Fear Questionnaire) a BAI (Beck Anxiety Inventory). Podle skóru FQ nebyly pozorovány žádné rozdíly mezi léčbou CBD a placebem (p < 0, 05). Výskyt nežádoucích účinků ve skupině CBD (n = 4, 10,3 %) byl velmi podobný jako ve skupině s placebem (n = 6, 15,4 %).48
V současné době probíhá další placebem kontrolovaná randomizovaná studie v terapii PTSD, kdy zkoušeným léčivem je CBD (NCT04197102). Od května byl spuštěn nábor pacientů v další multicentrické klinické studii, kde budou pacienti užívat dronabinol v léčbě PTSD (NCT04448808). Výsledky těchto klinických studií nebyly dosud zveřejněny.
ZÁVĚR
V terapii GAD a SAD byl zkoumán terapeutický vliv CBD, zatímco v terapii PTSD byly provedeny studie jak s CBD či THC, tak i s nabilonem. Bohužel žádné studie s inhibitory MAGL nebo FAAH u pacientů s poruchami úzkostného spektra provedeny nebyly. Na základě výsledků aktuálně dostupných publikovaných klinických studií se ukazuje, že kanabinoidy mohou představovat účinnou alternativní nebo komplementární terapii některých poruch úzkostného spektra (posttraumatická stresová porucha, generalizovaná úzkostná porucha a sociální fobie). Většina studií byla provedena na malých počtech pacientů, což samo o sobě představuje významnou limitaci. Vedle toho nízký počet subjektů snižuje možnost prokázání efektu. Klinické studie v terapii panické poruchy nebyly dosud provedeny. Byly provedeny čtyři randomizované klinické studie, kde byly kanabinoidy v terapii úzkostných poruch porovnávané s placebem. Ve všech případech se jednalo o CBD v terapii SAD. Příznivé výsledky ostatních studií mohou být ovlivněny absencí kontrolní skupiny, popř. heterogenní komedikací, užíváním konopí pro rekreační nebo samoléčebné účely před zařazením do studie a nekontrolovanou nebo špatně kontrolovanou délkou wash-out periody před zařazením do studie. Tím mohlo dojít k ovlivnění symptomů onemocnění způsobených abstinenčními příznaky při vysazení konopí před zařazením. V současné době probíhají dvě další klinické studie hodnotící účinek CBD a dronabinolu v terapii PTSD. Vzhledem k tomu, že kanabinoidy vykazují v rámci některých efektů bifázický účinek a rozmezí dávek se ve studiích pohybovalo v širokém intervalu, bude nutné pro definitivní stanovení optimálního dávkování ověřit více dávkovacích schémat jednotlivých kanabinoidů. V uvedených studiích autoři hodnotili účinky pomoci validovaných dotazníků a škál, popř. sledovali místa účinku kanabinoidů neurozobrazovacími metodami, avšak v žádné studii neměřili plazmatické hladiny podávaných látek a nekorelovali je s efektem pro případné stanovení referenčního rozmezí. Navíc v případě CBD je rozpětí dávek použitých ve studiích velmi široké (30-600 mg). Přestože tedy dostupná data ukazují na slibný potenciál kanabinoidů v terapii úzkostných poruch, měli bychom z výše uvedených důvodů výsledky interpretovat s velkou opatrností a pro definitivní potvrzení nálezů bude nutné vyčkat na závěry dobře designovaných prospektivních, randomizovaných kontrolovaných klinických studií.
LITERATURA
- 1. Praško J, Laňková J. Úzkostné poruchy: doporučený diagnostický a léčebný postup pro všeobecné praktické lékaře. Společnost všeobecného lékařství ČLS JEP 2006.
- 2. Tašková I. Úzkostné poruchy a jejich léčba. Prakt Lékáren 2021; 17: 207-212.
- 3. Murrough JW, Yaqubi S, Sayed S, Charney DS. Emerging drugs for the treatment of anxiety. Expert Opin Emerg Drugs 2015; 20: 393-406.
- 4. Griebel G, Holmes A. 50 years of hurdles and hope in anxiolytic drug discovery. Nat Rev Drug Discov 2013; 12: 667-687.
- 5. Aggarwal SK et al. Medicinal use of cannabis in the United States: Historical perspectives, current trends, and future directions. J Opioid Manag 2018; 5: 153.
- 6. Blessing EM, Steenkamp MM, Manzanares J, Marmar CR. Cannabidiol as a Potential Treatment for Anxiety Disorders. Neurotherapeutics 2015; 12: 825-836.
- 7. Di Marzo V, Melck D, Bisogno T, De Petrocellis L. Endocannabinoids: endogenous cannabinoid receptor ligands with neuromodulatory action. Trends Neurosci 1998; 21: 521-528.
- 8. UpToDate. Deepika S, Arnsten JH. Medical use of cannabis and cannabinoids in adults, 2023.
- 9. UpToDate. Cannabidiol (pharmaceutical): Drug information, 2023.
- 10. UpToDate. Nabilone (United States: Not available): Drug information, 2023.
- 11. UpToDate. Dronabinol: Drug information, 2023.
- 12. Fišar Z. Kanabinoidy a duševní poruchy. Čes a slov Psychiat 2008; 104: 297-307.
- 13. Lisboa SF et al. Tempering aversive/ traumatic memories with cannabinoids: a review of evidence from animal and human studies. Psychopharmacology (Berl) 2019; 236: 201-226.
- 14. Martin-Santos R et al. Acute effects of a single, oral dose of d9-tetrahydrocan-nabinol (THC) and cannabidiol (CBD) administration in healthy volunteers. Curr Pharm Des 2012; 18: 4966-4979.
- 15. McGregor IS, Dastur FN, McLellan RA, Brown RE. Cannabinoid modulation of rat pup ultrasonic vocalizations. Eur J Pharmacol 1996; 313: 43-49.
- 16. Chaperon F, Thiebot M-H. Behavioral effects of cannabinoid agents in animals. Crit Rev Neurobiol 1999; 13: 243-281.
- 17. Boggs DL, Nguyen JD, Morgenson D, Taffe MA, Ranganathan M. Clinical and preclinical evidence for functional interactions of cannabidiol and A9-tetrahydrocannabinol. Neuropsychopharmacology 2018; 43: 142-154.
- 18. Welch SP, Eads M. Synergistic interactions of endogenous opioids and cannabinoid systems. Brain Res 1999; 848: 183-190.
- 19. Pugh G, Mason DJ, Combs V, Welch SP. Involvement of dynorphin B in the antinociceptive effects of the cannabinoid CP55,940 in the spinal cord. J Pharmacol Exp Ther 1997; 281: 730-737.
- 20. Berrendero F, Maldonado R. Involvement of the opioid system in the anxiolytic-like effects induced by A9-tetrahydrocannabinol. Psychopharmacology (Berl) 2002; 163: 111-117.
- 21. Sante AB, Nobre MJ, Brandäo ML. Place aversion induced by blockade of p or activation of k opioid receptors in the dorsal periaqueductal gray matter: Behav Pharmacol 2000; 11: 583-589.
- 22. Zimmer A et al. Absence of A-9-tetrahydrocannabinol dysphoric effects in dynorphin-deficient mice. J Neurosci 2001; 21: 9499-9505.
- 23. Katona I et al. Distribution of CB1 cannabinoid receptors in the amygdala and their role in the control of GABAergic transmission. J Neurosci 2001; 21: 9506-9518.
- 24. Onaivi ES, Green MR, Martin BR. Pharmacological characterization of cannabinoids in the elevated plus maze. J Pharmacol Exp Ther 1990; 253: 10021009.
- 25. Griebel G. 5-Hydroxytryptamine-in-teracting drugs in animal models of anxiety disorders: more than 30 years of research. Pharmacol Ther 1995; 65: 319-395.
- 26. Malone DT, Taylor DA. Involvement of somatodendritic 5-HT1A receptors in A9-tetrahydrocannabinol-induced hypothermia in the rat. Pharmacol Biochem Behav 2001; 69: 595-601.
- 27. Egashira N et al. Involvement of 5-hydroxytryptamine neuronal system in A9-tetrahydrocannabinol-induced impairment of spatial memory. Eur J Pharmacol 2002; 445: 221-229.
- 28. Aso E et al. Lack of CB 1 receptor activity impairs serotonergic negative feedback. J Neurochem 2009; 109: 935944.
- 29. Moranta D, Esteban S, García-Sevilla JA. Chronic treatment and withdrawal of the cannabinoid agonist WIN 55,212-2 modulate the sensitivity of presynaptic receptors involved in the regulation of monoamine syntheses in rat brain. Naunyn Schmiedebergs Arch Pharmacol 2009; 379: 61-72.
- 30. Zavitsanou K, Wang H, Dalton VS, Nguyen V. Cannabinoid administration increases 5HT1A receptor binding and mRNA expression in the hippocampus of adult but not adolescent rats. Neuroscience 2010; 169: 315-324.
- 31. Fan P. Cannabinoid agonists inhibit the activation of 5-HT3 receptors in rat nodose ganglion neurons. J Neurophysiol 1995; 73: 907-910.
- 32. Cheer J. Modification of 5-HT2 receptor mediated behaviour in the rat by oleamide and the role of cannabinoid receptors. Neuropharmacology 1999; 38: 533-541.
- 33. Gaetani S, Cuomo V, Piomelli D. Anan-damide hydrolysis: a new target for anti-anxiety drugs? Trends Mol Med 2003; 9: 474-478.
- 34. Bortolato M et al. Anxiolyticlike properties of the anandamide transport inhibitor AM404. Neuropsychopharmacology 2006; 31: 2652-2659.
- 35. Patel S, Hillard CJ. Pharmacological evaluation of cannabinoid receptor ligands in a mouse model of anxiety: further evidence for an anxiolytic role for endogenous cannabinoid signaling. J Pharmacol Exp Ther 2006; 318: 304311.
- 36. Navarro M et al. Acute administration of the CB1 cannabinoid receptor antagonist SR 141716A induces anxiety-like responses in the rat: NeuroReport 1997; 8: 491-496.
- 37. Haller J, Bakos N, Szirmay M, Ledent C, Freund TF. The effects of genetic and pharmacological blockade of the CB1 cannabinoid receptor on anxiety: Anxiety and cannabinoids. Eur J Neurosci 2002; 16: 1395-1398.
- 38. Degroot A, Nomikos GG. Genetic deletion and pharmacological blockade of CB1 receptors modulates anxiety in the shock-probe burying test. Eur J Neurosci 2004; 20: 1059-1064.
- 39. Fraser G. A. The use of a synthetic cannabinoid in the management of treatment-resistant nightmares in Posttraumatic Stress Disorder (PTSD). CNS Neurosci Ther 2009; 15: 84-88.
- 40. Roitman P, Mechoulam R, Cooper-Kazaz R, Shalev A. Preliminary, open-label, pilot study of add-on oral A9-tetrahydrocannabinol in chronic Post-Traumatic Stress Disorder. Clin Drug Investig 2014; 34: 587-591.
- 41. Cameron C, Watson D, Robinson J. Use of a synthetic cannabinoid in a correctional population for Posttraumatic Stress Disorder related insomnia and nightmares, chronic pain, harm reduction, and other indications: a retrospective evaluation. J Clin Psychopharmacol 2014; 34: 559-564.
- 42. Jetly R, Heber A, Fraser G, Boisvert D. The efficacy of nabilone, a synthetic cannabinoid, in the treatment of PTSD-associated nightmares: a preliminary randomized, double-blind, placebo-controlled cross-over design study. Psychoneuroendocrinology 2015; 51: 585-588.
- 43. Elms L, Shannon S, Hughes S, Lewis N. Cannabidiol in the treatment of Post-Traumatic Stress Disorder: a case series. J Altern Complement Med 2019; 25: 392-397.
- 44. Bolsoni LM, Crippa JAS, Hallak JEC, Guimaräes FS, Zuardi AW. Effects of cannabidiol on symptoms induced by the recall of traumatic events in patients with posttraumatic stress disorder. Psychopharmacology (Berl) 2022; 239: 1499-1507.
- 45. Bergamaschi MM et al. Cannabidiol reduces the anxiety induced by simulated public speaking in treatment-naive social phobia patients. Neuropsychopharmacology 2011; 36: 1219-1226.
- 46. Crippa JAS et al. Neural basis of anxiolytic effects of cannabidiol (CBD) in generalized social anxiety disorder: a preliminary report. J Psychopharmacol (Oxf) 2011; 25, 121-130.
- 47. Masataka N. Anxiolytic effects of repeated cannabidiol treatment in teenagers with social anxiety disorders. Front Psychol 2019; 10: 2466.
- 48. Kwee CM et al. Cannabidiol enhancement of exposure therapy in treatment refractory patients with social anxiety disorder and panic disorder with agoraphobia: a randomised controlled trial. Eur Neuropsychopharmacol 2022; 59: 58-67.





